阿尔法粒子是什么东西(为什么只需改变一个质子,就能改变一个元素?)
在元素周期表的118个元素中,为什么只需要给原子增加或者减少一个质子,元素的性质就会截然不同。
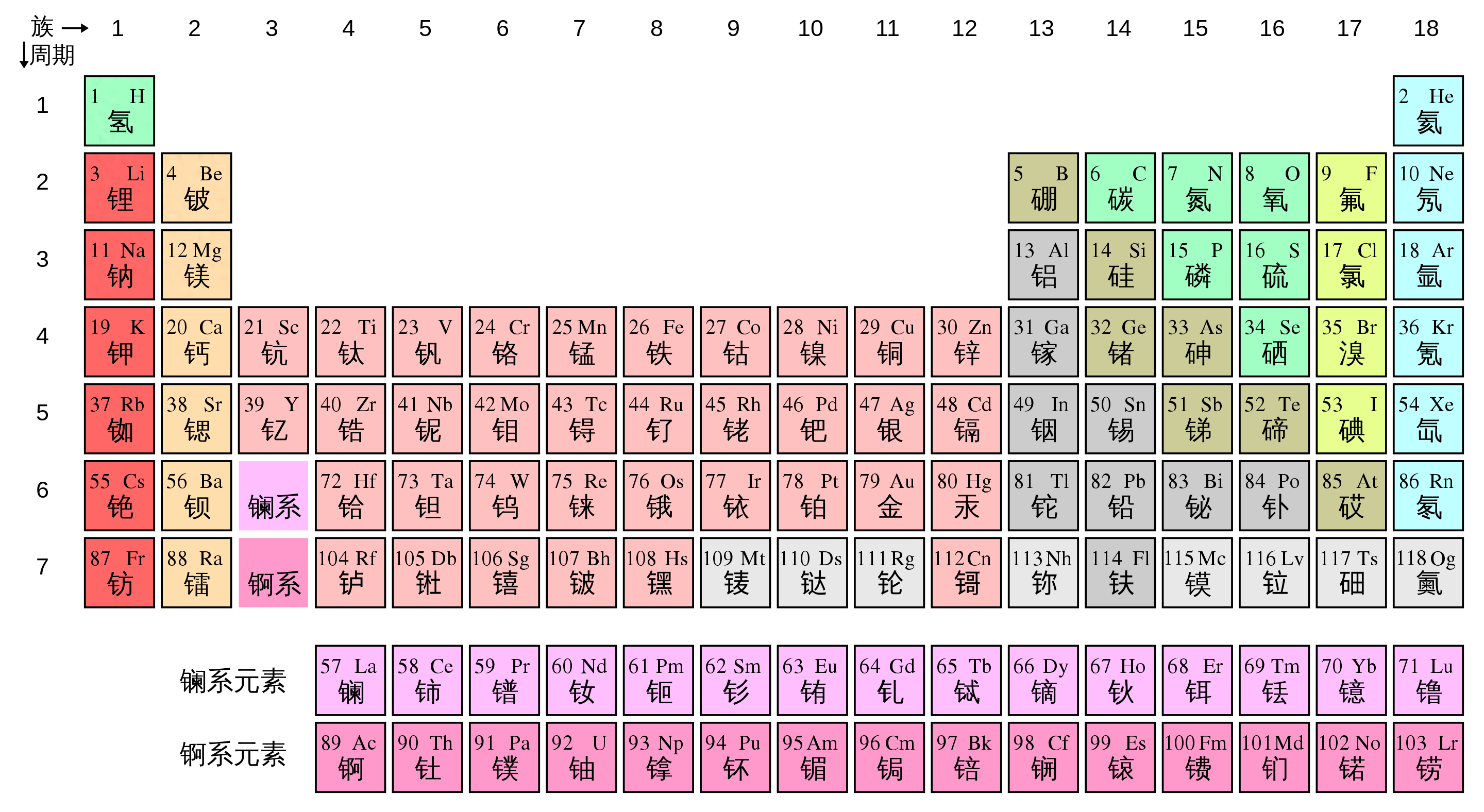
在元素周期表中,我们发现所有的元素只是原子序数不同,原子序数又取决于原子核内质子的数量。原子核中每增加一个质子,元素就会改变。这种改变甚至会造成元素的性质大变,比如以19号元素钾为例,它有19个质子,它在温室的情况下是一种银白色的金属,质地也比较柔软,可以轻易的用刀切割,但是它的化学活性却很高,放在水中就会起火。因为它会产生氢气和大量的热量,氢气和氧气结合的时候就会被点燃。

但如果只把钾元素的一个质子拿掉,变成18个质子的原子核,这时候元素就会变成了氩,这是一种惰性气体,性质十分稳定,它几乎不会和其他物质发生化学反应。
但如果我们给钾原子增加一个质子,这时候元素就变成了钙,这是一种固体,并且比较坚硬。
在氩,钾,钙三种元素中,原子核的组成成分几乎没有区别,都是质子加中子的组合,只是质子数量改变了一个,但是化学性质却天翻地覆。
这也就是我们常说的结构决定性质。所以就有人说是质子决定了宇宙物质的种类,才使得宇宙变得如此多姿多彩。
那为什么质子会如此神奇呢?
首先,所有的原子都要保持电中性,我们知道原子是由原子核和核外电子构成的。原子核带正电是因为质子带正电,所以原子核的电荷完全由质子决定,而原子核外又有一群电子,电子带负电。所以原子核要想保持电中性,整个原子内的质子数量就得严格的与电子数量保持同步。这样一来,正电荷和负电荷才能抵消。所以质子数量的改变,本质改变的是核外电子的数量。而核外电子才是决定元素化学性质的关键因素。

既然电子的数量才是决定元素性质的关键,那为什么在化学课本上,我们常说原子的种类由质子决定呢?而不是直接由电子的数量决定原子序数呢?
其实这主要是因为很多元素的核外电子并不稳定。
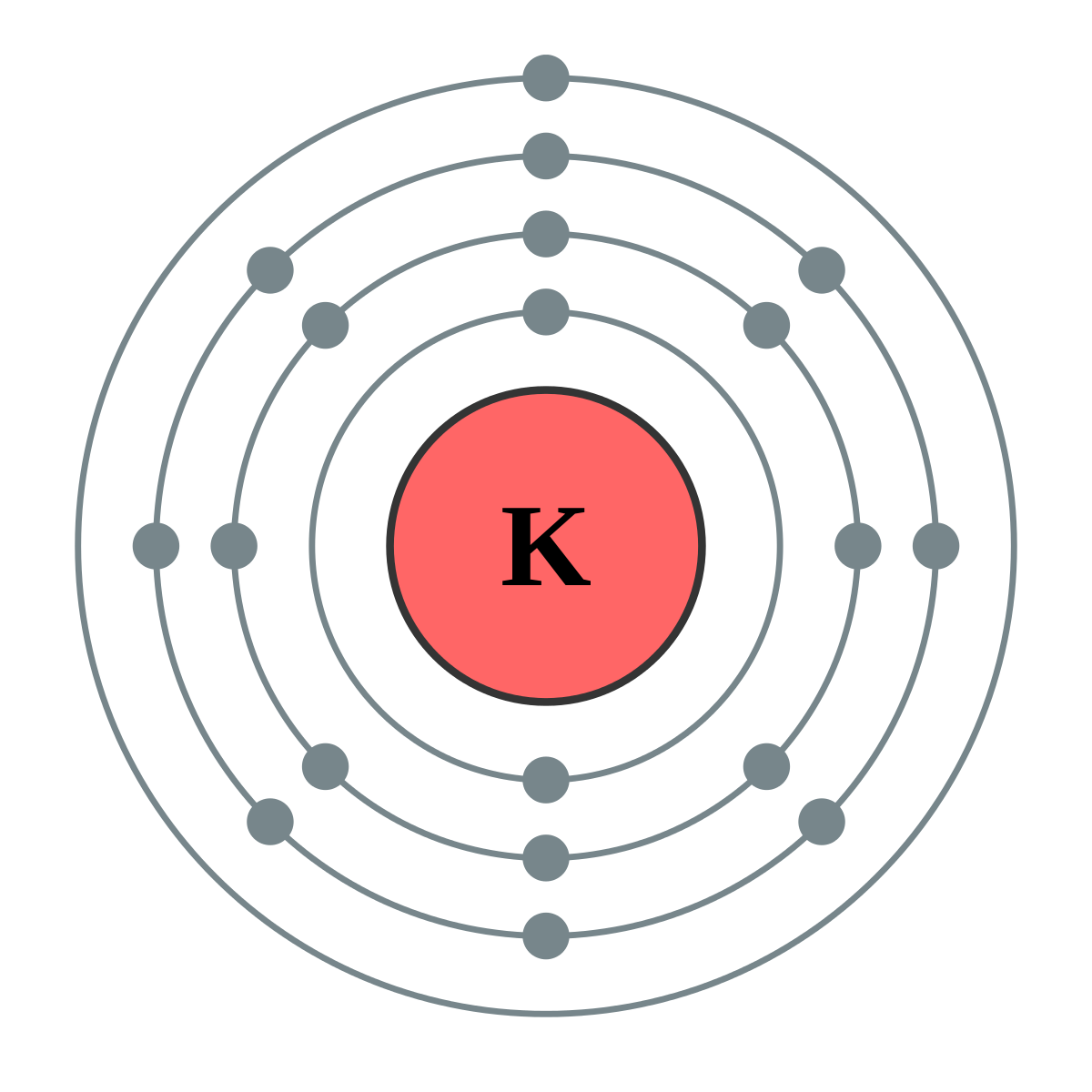
我们依旧以钾元素举例,钾元素最外层只有一个电子,根据泡利不相容原理,同一能层的同一能级只能容纳两个电子,所以钾原子最外层单电子就很容易与其他元素的核外电子共享同一能级。比如氯元素最外层也只有一个电子。
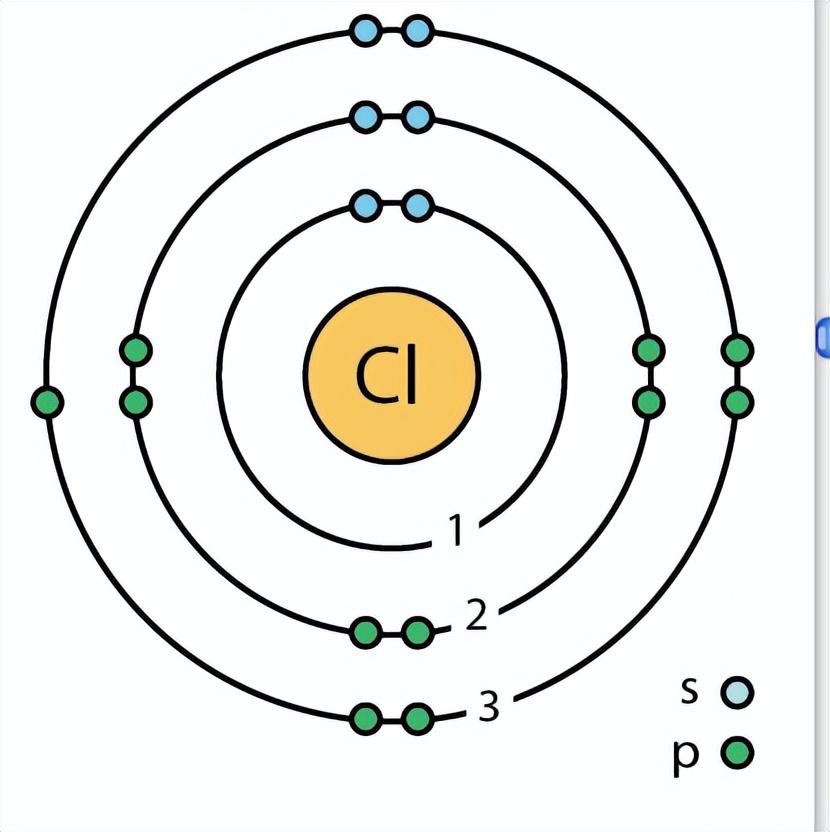
这时候钾元素的最外层单电子很容易被氯元素的核外电子吸引过去,从而形成氯化钾。所以钾元素在自然界中通常以带正电子的离子形式存在。
这个时候的钾离子核外就只有18个电子了,其核外电子数量和氩原子数量就一样了,即使钾离子的电子数量相同与氩原子完全相同,但化学性质却与氩元素完全不同。所以我们才不能用电子的数量决定原子的种类。

看到这里,可能会有人问,钾元素和氯元素最外层都只有一个电子,为什么是氯元素把钾元素的电子吸引过去,而不是钾元素把氯元素的电子吸引过来呢。
其实这里面起作用的就是能量最低原理,也就是说,核外电子一般情况下先会占据能量最低的能级,如果最低的能级被占满了,才会被迫转移到更高的能级上。
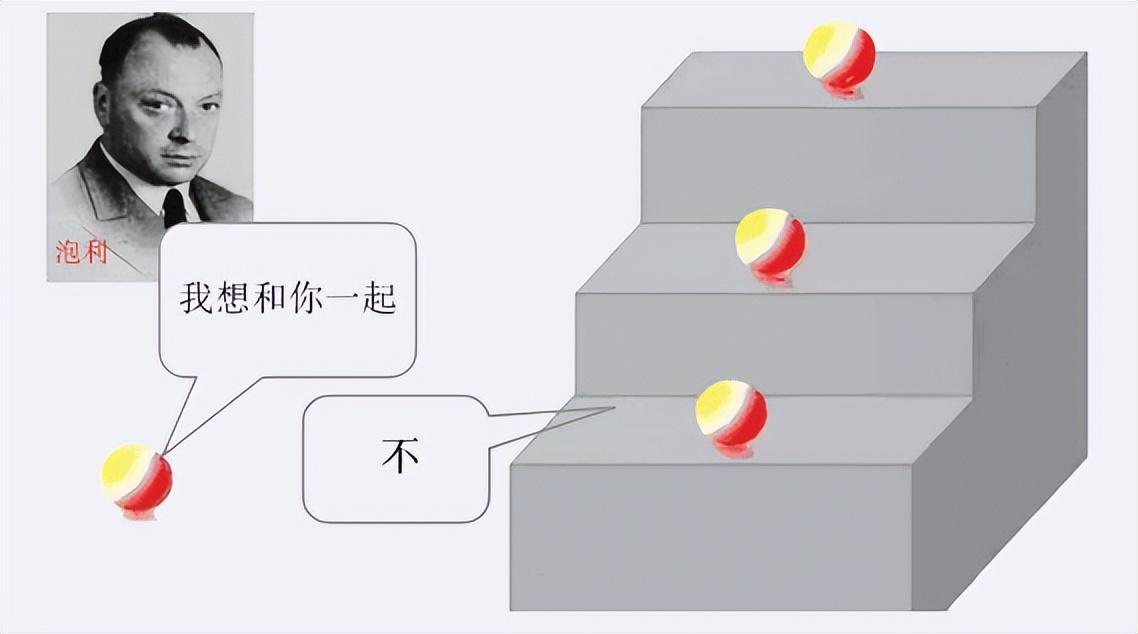
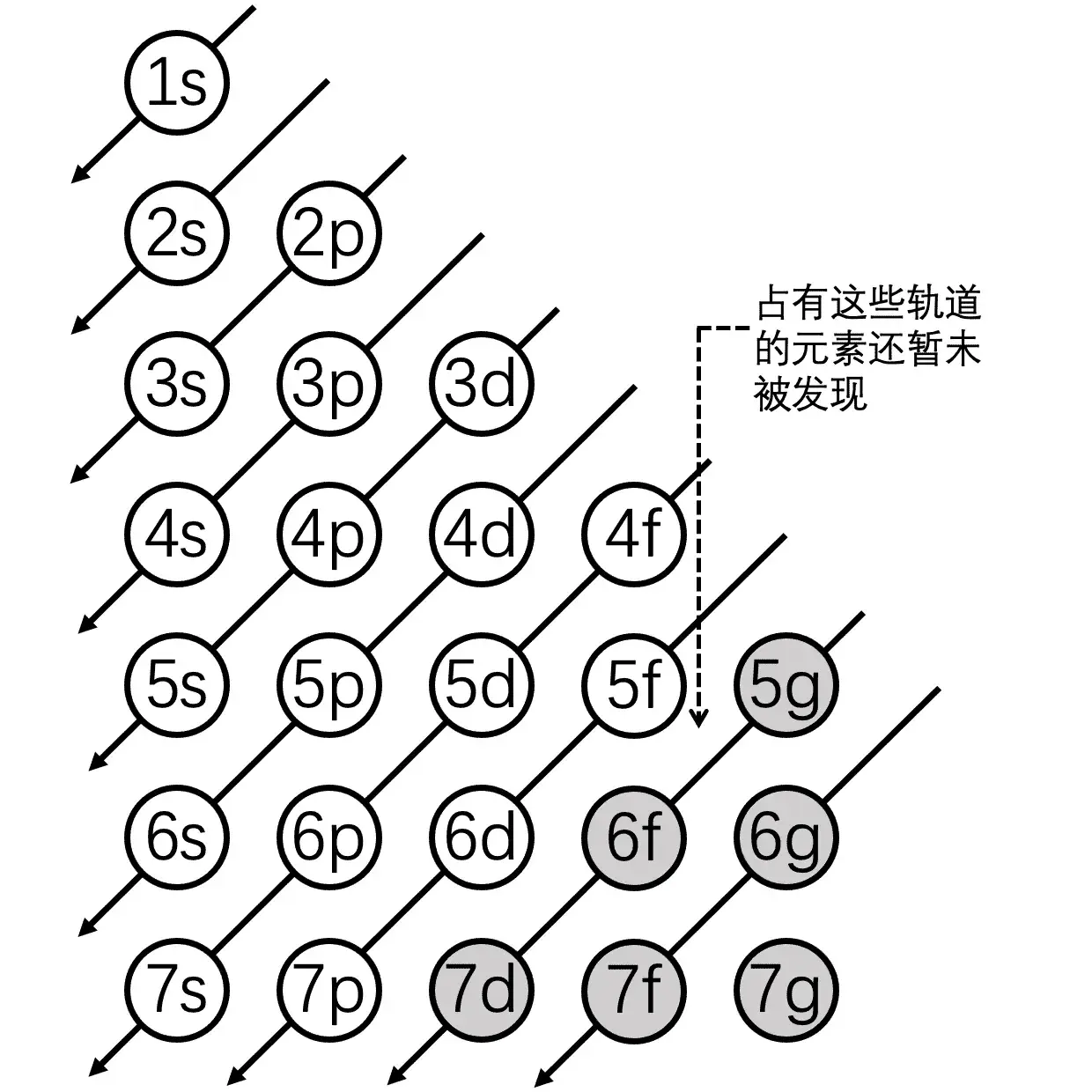
一般情况下,越靠近原子核的能层,其能量也就越低,而钾原子的最外层单电子在第四个能层上,氯原子的最外层电子在第三个能层上。所以根据能量最低原理,是钾元素的单电子会被氯元素拉拢过去。当然,并不是说所有的高能层的电子能级能量就一定大于低能层的能量。这里面有一个能量交错原理,具体情况如图所示。
事实上,只要质子的数量不发生改变,核外电子的数量并不能直接改变元素的种类和特性。因为核外电子数量的改变充其量也只是化学反应,而要想质子数量发生改变,就得靠衰变反应。
那什么是衰变反应呢?
我们知道原子核的质子数量越多,其核外电子数量也就得越多,能层也就不断增加。而能层越高,能量也就越大,那么,要维持整个原子结构的稳定就越不容易。
而自然界的原子本质都遵守能量最低原理,电子轨道能量越低,越稳定。所以为了维持这种稳定,原子核就会通过各种方式削减质子的数量从而减少核外电子的数量,比如通过弱力的β衰变,将质子变成中子,也就是质子中的一个上夸克通过弱力变成下夸克。这样质子就变成中子了,由于质子数目的减少,核外电子数目也会变少,这样整个原子结构就会变得更加稳定。
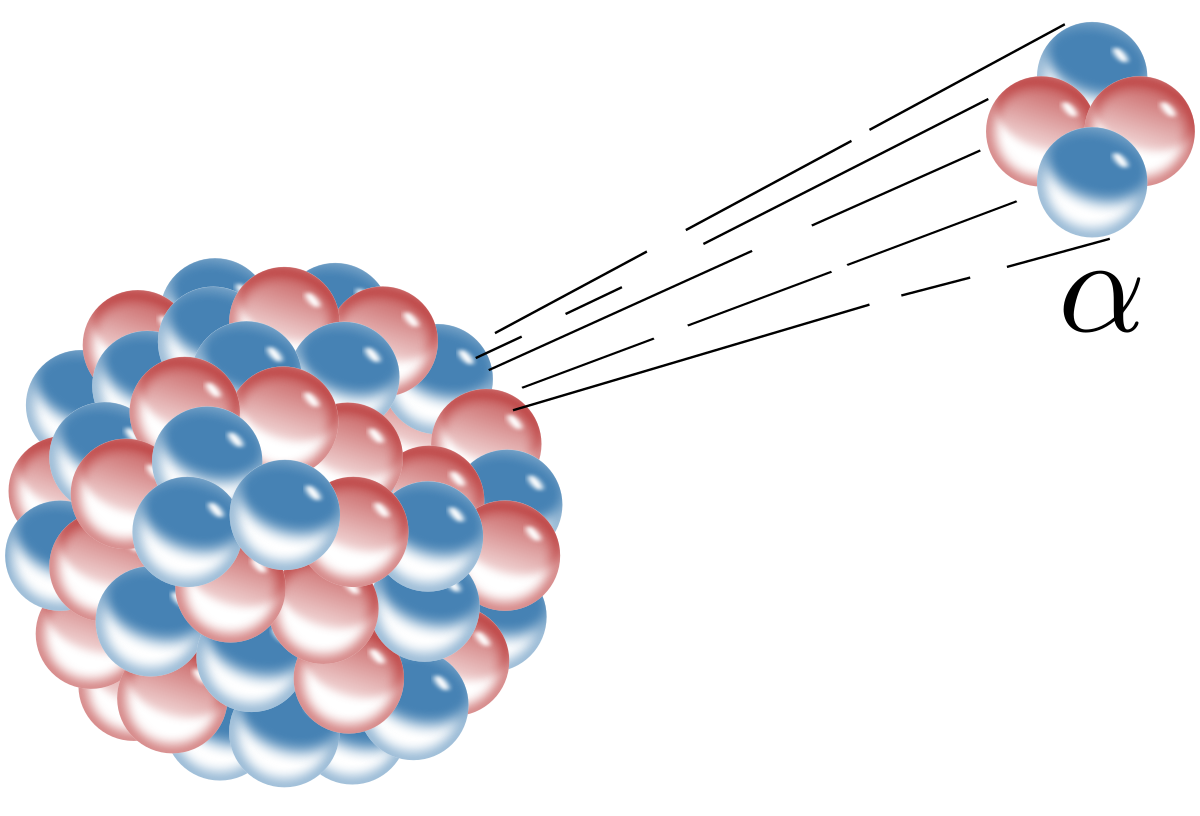
而有的时候,原子核内的质子数目实在太多,比如常见的放射性元素,只靠β衰变将上夸克变成下夸克,从而将质子变成中子的效率太低,还不足以让原子结构快速变得稳定。这时候就得上α衰变,也就是直接将原子核中的质子和中子扔出去,一般是两个质子和两个中子,这也就是阿尔法粒子,即一个氦原子核。
所以说质子数量的改变只能通过衰变来改变,而质子数量直接决定核外电子的数量,而核外电子的数量决定了它们的能级分布,这些电子在不同能级下会形成不同的化学键 从而决定了元素的化学和物理性质。
